- Hiên tượng điện phân
- Khái niệm
– Điện phân là quá trình oxi hóa – khử xảy ra trên bề mặt các điện cực khi có dòng điện một chiều đi qua chất điện li nóng chảy hoặc dung dịch chất điện li.
- Nguyên tắc (thứ tự) điện phân
– Cathode (cực âm): Xảy ra quá trình khử ion dương.
– Anode (cực dương): Xảy ra quá trình oxi hóa ion âm.
- Nguyên tắc điện phân nóng chảy
– Nguyên tắc khử ở cathode: Chất oxi hóa mạnh hơn bị khử trước.
– Nguyên tắc oxi hóa ở anode: Chất khử mạnh hơn bị oxi hóa trước.
♦ Điện phân nóng chảy NaCl điện cực trơ (graphite)
– Khi nóng chảy: NaCl → Na+ + Cl– khi có dòng điện Na+, Cl– di chuyển về các điện cực
|
Cathode (-): Na+ |
Anode (+): Cl– |
|
Na+ + 1e → Na |
2Cl– → Cl2 + 2e |
– Phương trình hóa học của phản ứng điện phân: 2NaCl 2Na + Cl2
- Nguyên tắc điện phân dung dịch
– Nguyên tắc khử ở cathode: Chất oxi hóa mạnh hơn bị khử trước.
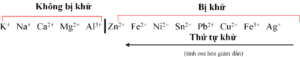
– Nguyên tắc oxi hóa ở anode: Chất khử mạnh hơn bị oxi hóa trước.
+ Các anion chứa oxygen như SO42-, CO32-, NO3–, PO43-, ClO4– và F– coi như không bị điện phân.
+ Các ion còn lại điện phân theo thứ tự: I– → Br– → Cl– → H2O
– Quá trình oxi hóa và khử H2O:
|
H2O bị khử ở cathode |
H2O bị oxi hóa ở anode |
|
2H2O + 2e → H2 + 2OH– |
2H2O → O2 + 4H+ + 4e |
♦ Điện phân dung dịch CuSO4 với các điện cực trơ (graphite)
– Trong dung dịch: CuSO4 → Cu2+ + SO42- khi có dòng điện Cu2+, SO42- di chuyển về các điện cực:
|
Cathode (-): Cu2+, H2O |
Anode (+): SO42-, H2O |
|
Cu2+ + 2e → Cu |
2H2O → O2 + 4H+ + 4e |
– Phương trình hóa học của phản ứng điện phân:
CuSO4 + H2O Cu + ½ O2↑ + H2SO4
♦ Điện phân dung dịch NaCl với các điện cực trơ (graphite)
– Trong dung dịch: NaCl → Na+ + Cl– khi có dòng điện Na+, Cl– di chuyển về các điện cực
|
Cathode (-): Na+, H2O |
Anode (+): Cl–, H2O |
|
2H2O + 2e → H2 + 2OH– |
2Cl– → Cl2 + 2e |
– Phương trình hóa học của phản ứng điện phân:
NaCl + H2O NaOH + H2↑ + Cl2↑
– Khi điện phân dung dịch NaCl không có màng ngăn thì Cl2 và NaOH sinh ra sẽ phản ứng với nhau tạo nước Javel theo phương trình:
Cl2 + 2NaOH → NaCl + NaClO + H2O
- Ứng dụng của phương pháp điện phân
- Sản xuất kim loại
– Trong công nghiệp, các kim loại trung bình và yếu (yếu hơn Al) được sản xuất bằng phương pháp điện phân dung dịch.
– Các kim loại mạnh như Na, K, Mg, Ca, Al, … được sản xuất bằng phương pháp điện phân nóng chảy hợp chất ion của chúng.
VD: Trong công nghiệp, nhôm được sản xuất bằng phương pháp điện phân nóng chảy Al2O3 (lấy từ quặng bauxite: Al2O3.2H2O), điện cực than chì, có mặt cryolite (Na3AlF6) nóng chảy.
|
Cathode (-): Al3+ |
Anode (+): O2- |
|
Al3+ + 3e → Al |
2O2- → O2 + 4e |
♦ Phương trình hóa học của phản ứng điện phân: 2Al2O3 4Al + 3O2
♦ Cryolite có ba tác dụng: Hạ nhiệt độ nóng chảy của Al2O3 giúp tiết kiệm năng lượng, tạo ra chất lỏng dẫn điện tốt, nhẹ nổi lên trên ngăn cách Al lỏng tạo thành với không khí.
♦ Khí O2 sinh ra tác dụng với điện cực anode than chì thành CO và CO2 nên cần hạ thấp dần các điện cực anode vào thùng điện phân.

- Ứng dụng của phương pháp điện phân
- Sản xuất kim loại
– Trong công nghiệp, các kim loại trung bình và yếu (yếu hơn Al) được sản xuất bằng phương pháp điện phân dung dịch.
– Các kim loại mạnh như Na, K, Mg, Ca, Al, … được sản xuất bằng phương pháp điện phân nóng chảy hợp chất ion của chúng.
VD: Trong công nghiệp, nhôm được sản xuất bằng phương pháp điện phân nóng chảy Al2O3 (lấy từ quặng bauxite: Al2O3.2H2O), điện cực than chì, có mặt cryolite (Na3AlF6) nóng chảy.
|
Cathode (-): Al3+ |
Anode (+): O2- |
|
Al3+ + 3e → Al |
2O2- → O2 + 4e |
♦ Phương trình hóa học của phản ứng điện phân: 2Al2O3 4Al + 3O2
♦ Cryolite có ba tác dụng: Hạ nhiệt độ nóng chảy của Al2O3 giúp tiết kiệm năng lượng, tạo ra chất lỏng dẫn điện tốt, nhẹ nổi lên trên ngăn cách Al lỏng tạo thành với không khí.
♦ Khí O2 sinh ra tác dụng với điện cực anode than chì thành CO và CO2 nên cần hạ thấp dần các điện cực anode vào thùng điện phân.
- Mạ điện
– Phương pháp điện phân với anode tan cũng được sử dụng trong kĩ thuật mạ điện nhằm bảo vệ kim loại không bị ăn mòn và làm cho chúng trở nên sáng bóng, đẹp với lớp mạ rất mỏng.
– Trong kĩ thuật mạ điện, anode là kim loại dùng để mạ (như Ag, Cu, A, Cr, Ni, Sn, …) và cathode là vật cần mạ.
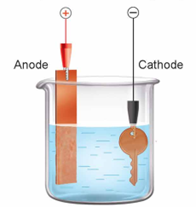
VD: Để mạ đồng lên một chiếc chìa khóa người ta tiến hành điện phân dung dịch CuSO4 với anode là kim loại Cu và cathode là chiếc chìa khóa.
♦ Tại anode: Cu → Cu2+ + 2e
♦ Tại cathode: Cu2+ + 2e → Cu
– Độ dày lớp mạ tỉ lệ thuận với cường độ dòng điện chạy qua dung dịch điện phân và thời gian mạ.
