- Lý thuyết về điện phân
♦ Điện phân nóng chảy
– Nguyên tắc khử ở cathode: Chất oxi hóa mạnh hơn bị khử trước.
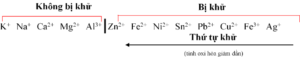
– Nguyên tắc oxi hóa ở anode: Chất khử mạnh hơn bị oxi hóa trước.
♦ Điện phân dung dịch
– Nguyên tắc khử ở cathode: Chất oxi hóa mạnh hơn bị khử trước.
– Nguyên tắc oxi hóa ở anode: Chất khử mạnh hơn bị oxi hóa trước.
+ Các anion chứa oxygen như SO42-, CO32-, NO3–, PO43-, ClO4– và F– coi như không bị điện phân.
+ Các ion còn lại điện phân theo thứ tự: I– → Br– → Cl– → H2O
– Quá trình oxi hóa và khử H2O:
|
H2O bị khử ở cathode |
H2O bị oxi hóa ở anode |
|
2H2O + 2e → H2 + 2OH– |
2H2O → O2 + 4H+ + 4e |
♦ Điện lượng:
Trong đó: là điện lượng là số mol electron đi qua dây dẫn, là cường độ dòng điện là thời gian (giây), là hằng số Faraday .
- Phương pháp giải bài tập điện phân
– Sử dụng định luật bảo toàn e: .![]()
– mdd giảm = mkim loại + mkhí.
– mcathode tăng = mkim loại sinh ra.
– Khi điện phân dung dịch hỗn hợp nhiều chất thì viết quá trình điện phân tại các điện cực theo thứ tự và dựa vào giữ kiện đề bài như mol e trao đổi, mdd giảm, mcathode tăng, bắt đầu thoát khí, … để xác định xem phản ứng dừng lại ở đâu.
– Khi điện phân tại các thời điểm khác nhau thì thời gian tỉ lệ thuận với mol e trao đổi: ![]()
